Oxford und Berlin gemeinsam gegen gefährliche Keime
Zwei Cooperation Groups widmen sich im Rahmen der Grand Challenge Global Health der Erforschung von Antibiotikaresistenzen
26.02.2024
Global Health – der Einsatz für die weltweite Bekämpfung von Krankheiten und eine bessere Gesundheitsversorgung – wird von der BUA als „Grand Challenge“ in zahlreichen, auch internationalen Projekten explizit gefördert. Dazu gehört auch der Kampf gegen multiresistente Keime, denen Jahr für Jahr zahlreiche Menschen zum Opfer fallen. Zwei dieser Projekte spannen Forscher*innen aus Berlin und Oxford zusammen.
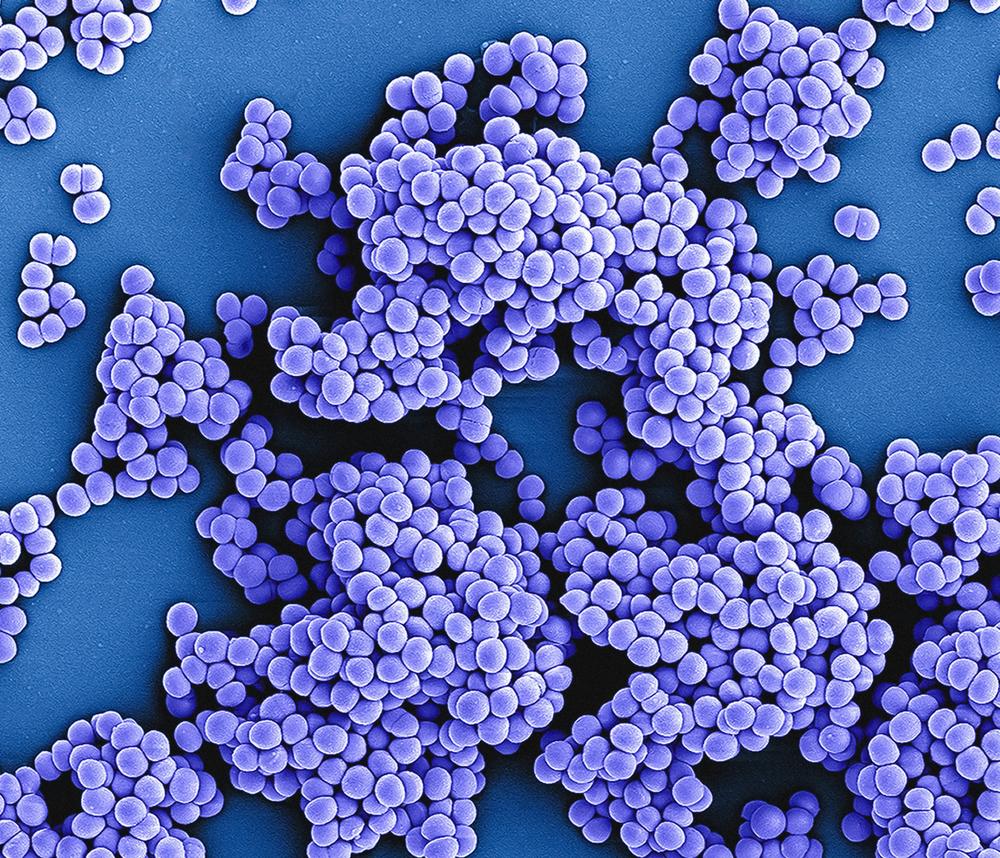
Viele Krankenhausinfektionen werden durch Methicillin-resistente Staphylococcus aureus-Stämme – kurz MRSA genannt – verursacht.
Bildquelle: National Institute of Allergy and Infectious Diseases/Unsplash
Weltweit sterben jährlich Millionen Menschen an den Folgen einer Infektion mit multiresistenten Keimen. Das Risiko, sich mit Bakterien zu infizieren, die nicht mehr auf Antibiotika ansprechen, oder an einer Pilzinfektion zu erkranken, die sich nicht mehr mit antifungalen Medikamenten bekämpfen lässt, steigt seit Jahren. Forscher*innen gehen davon aus, dass Infektionen mit Antibiotikaresistenzen bis 2050 Krebs als Ursache für die menschliche Sterblichkeit überholen werden.
Mangelnde Hygiene in Krankenhäusern oder Pflegeeinrichtungen sind das Einfallstor für resistente Bakterien, die zu den gefürchteten Krankenhausinfektionen führen. Zu solchen nosokomialen Infektionen gehören methicillin-resistente Staphylococcus aureus-Stämme – kurz MRSA.
Grand Challenge Global Health: Oxford - Berlin
Nach Lösungen gegen die abnehmende Wirksamkeit antimikrobieller Medikamente suchen zwei international besetzte Forschungsgruppen im Rahmen der Oxford Berlin Research Partnership zwischen der Berlin University Alliance (BUA) und der University of Oxford: Sie untersuchen, welche Rolle Infektionskontrolle sowie doppelte Infektionen durch Bakterien und Pilze bei der Entwicklung von Antibiotikaresistenzen spielen. „Context-driven Infection Control Interventions“ und „Bacterial-Fungal Co-Infections and their Role in the Evolution of Antimicrobial-Resistance“ werden für je zwei Jahre von der BUA als „Grand Challenge Global Health“ gefördert. Die Förderung soll Forschungsergebnisse ermöglichen, auf deren Grundlage die Wissenschaftler*innen im Anschluss weitere, große Forschungsgrants einwerben werden.
Das Besondere an der Kooperation: In jedem Projekt arbeiten Principal Investigators (PI) und Postdocs in Oxford und Berlin gemeinsam an verschiedenen Aspekten des Themas und ergänzen sich dabei mit ihrer Expertise. Ihr Ziel ist, einen Beitrag zur Eindämmung von multiresistenten Keimen zu leisten.
Kooperation mit Nigeria
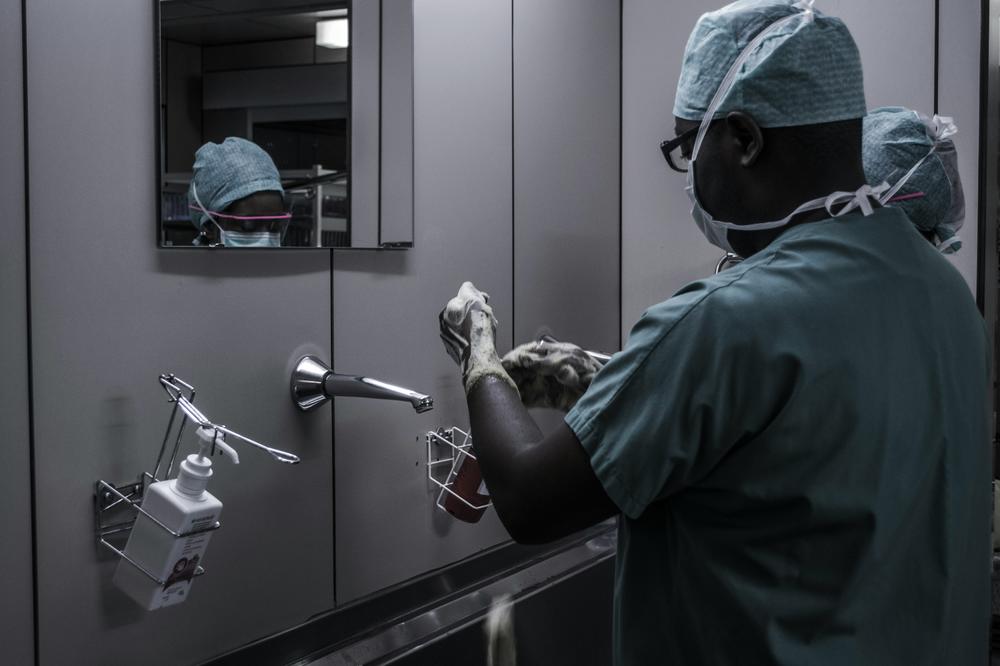
Die hygienischen Bedingungen sind ein zentraler Faktor bei der Ausbreitung von multiresistenten Keimen in Krankenhäusern
Bildquelle: Piron Guillaume/Unsplash
Als mit am stärksten betroffen von den Folgen multiresistenter Keime gelten Länder im westlichen Afrika südlich der Sahara. Eine internationale Forschergruppe veröffentlichte vor zwei Jahren dazu eine Studie im Fachmagazin „The Lancet“. In der Region hat es demnach auf 100.000 Menschen fast doppelt so viele Todesfälle gegeben wie in reichen Industrieländern.
Das Projekt „Context-Driven Infection Control Interventions“ der Mediziner*innen PD Dr. med. Friederike Maechler (Charité) und Professorin Christiane Dolecek sowie Professor Ben Cooper (Oxford) und Dr. Tochi Okwor (Nigeria) untersucht die Bedingungen, unter denen sich in nigerianischen Krankenhäusern multiresistente Keime ausbreiten, um daraus effektivere Überwachungsstrategien in den Kliniken zu entwickeln.
„Es gibt zwar bereits Studien zu Krankenhausinfektionen, doch die beziehen sich alle auf das Infektionsgeschehen in sogenannten High Income-Ländern in Europa oder Nordamerika“, erläutert Friederike Maechler die Ausgangslage zu Beginn des Projekts, das im Herbst 2021 startete. Auf die Situation in den Low and Middle Income-Ländern des sogenannten globalen Südens dagegen seien diese Studienergebnisse nur bedingt oder gar nicht anwendbar. Die Verhältnisse in Ländern wie Nigeria seien komplett andere.
Kein Zugang zu Wasser und Elektrizität
„Alleine die Tatsache, dass es in vielen Regionen keine Elektrizität und keinen ausreichenden Zugang zu Wasser gibt, schafft andere hygienische Verhältnisse“, betont Maechler. „Und wenn bereits so grundsätzliche Dinge wie regelmäßiges Händewaschen keine Selbstverständlichkeit sind, wird klar, warum viele nigerianische Kliniken mit anderen Herausforderungen konfrontiert sind als etwa deutsche, und warum Maßnahmen, die in einer deutschen Klinik eingeführt werden, in Nigeria wenig Sinn haben.“
Ein zusätzliches Problem ist, dass Krankenhauspatient*innen in Nigeria Desinfektionsmittel oder Medikamente selbst kaufen und ins Krankenhaus mitbringen müssen. „Auch Untersuchungen wie etwa Blutkulturen müssen selbst bezahlt werden. Blutkulturen sind sehr wichtig für die Diagnostik, um den zugrundeliegenden bakteriellen Erreger und dessen Resistenzprofil zu bestimmen,“ ergänzt Christiane Dolecek. Zudem gibt es zu wenige mikrobiologische Labors in Low and Middle Income-Ländern wie Nigeria.
Expertisen in Surveillanceforschung und Infektiologie
Friedrike Maechler koordiniert in Berlin am Institut für Hygiene und Umweltmedizin die Surveillance-Befragungen in den Kliniken. Dr. Tochi Okwor, Public Health-Expertin vom Nigeria Centre for Disease Control (NCDC) und PI auf nigerianischer Seite, spielt im Projekt ebenfalls eine wichtige Rolle, denn sie hat mit ihrem engagierten Team ein umfangreiches Surveillance-Netzwerk etabliert, das ein Eckpfeiler des Projekterfolgs ist.
Dolecek und ihr Kollege in Oxford, Ben Cooper, wiederum bringen ihre profunde Expertise in Infektiologie mit zahlreichen Übersichtsstudien zu Maßnahmen im Umgang mit multiresistenten Keimen in das Projekt ein. Gemeinsam leiten sie das Global Research on Antimicrobial Resistance (GRAM) Project.
Ausgewählt wurden Kliniken in sechs verschiedenen Regionen, im muslimisch geprägten, ärmeren Nordnigeria ebenso wie im christlich geprägten, wirtschaftlich besser gestellten Südnigeria. Befragt wurde medizinisches Personal jeweils auf normalen Tagesstationen wie auch auf Intensivstationen.
Mehrere Projektworkshops mit den Kolleg*innen aus Nigeria sowie aus sechs weiteren afrikanischen, asiatischen und europäischen Ländern haben schon in Berlin stattgefunden. Sie haben bereits vorhandene Kontakte in allen teilnehmenden Ländern verstärkt und das Netzwerk vergrößert. Reisekosten und Aufenthaltskosten für die Teamkolleg*innen aus Afrika konnten mit BUA-Mitteln finanziert werden. „Unser nächster Schritt ist, auf Grundlage unserer Ergebnisse größere Forschungsgrants einzuwerben, um die Arbeit auch über die drei Jahre hinaus fortsetzen zu können“, sagt Christiane Dolecek.
Interaktion von Bakterien und Pilzen
Die abnehmende Wirksamkeit antimikrobieller und antifungaler Medikamente ist eine der größten Herausforderungen in der Gesundheitsversorgung
Bildquelle: Diana Polekhina/Unsplash
Das zweite Projekt „Bacterial-Fungal Co-Infections and their Role in the Evolution of Antimicrobial Resistance“ wiederum nimmt die Verursacher der Infektionen in den Blick: die Biologie des Bakteriums Pseudomonas aeruginosa einerseits, den Metabolismus von Pilzen, die Infektionen im menschlichen Organismus verursachen, andererseits, und wie beides interagiert. Pseudomonas zählt weltweit zu den häufigsten Ursachen von nosokomialen Entzündungen. Patienten infizieren sich beispielsweise nach Operationen und erkranken an Wund- oder Harnwegsinfektionen bis hin zur Lungenentzündung und Sepsis.
Das Team auf BUA-Seite wird angeführt von Professor Markus Ralser, Direktor des Instituts für Biochemie an der Charité und zuvor Forschungsgruppenleiter am Francis Crick Institute in London, und Dr. Lisa Kahl, Postdoktorandin und Marie Skłodowska-Curie Stipendiatin, am selben Institut. Die Biochemiker*innen sind Experten im Bereich der Zellstoffwechselkoordination und der Entwicklung analytischer Methoden zur Bearbeitung komplexer biologischer Fragestellungen.
Im Projekt konzentriert sich die Charite Seite auf den Pilzmetabolismus, während die Partner in Oxford um Professor Craig McLean und Postdoktorandin Rachel Wheatley, sich mit der antibakteriellen Medikamentenresistenz von Pseudomonas befassen.
„Wir untersuchen, welche Rolle doppelte Infektionen durch Bakterien und Pilze bei der Entwicklung von Antibiotikaresistenzen spielen, und schauen uns dafür die Genetik der Zellen an“, erläutert Markus Ralser. „In der Regel sind die meisten Pilzinfektionen nämlich für den menschlichen Organismus nicht lebensbedrohlich.“
Liege jedoch eine invasive Infektion vor – wenn beispielsweise der Kreislauf oder ein Organ betroffen sind – sei das Risiko einer schlechten Prognose sehr hoch. „Auch sind die Mechanismen der Arzneimitteltoleranz bei Pilzen anders als in Bakterien. Wo Bakterien häufig genetisch bedingte Antibiotikaresistenzen entwickeln, ist das bei Pilzen eher selten. Pilze bilden aber nicht-genetisch bedingte Toleranzen gegenüber antifungalen Medikamenten aus, und sprechen dann nicht mehr auf diese an.“
Organismus kämpft gegen zwei Infektionen
Die Realität ist aber komplizierter. Das Team stellte bei Laborexperimenten fest: Pseudomonas und Pilze beeinflussen sich gegenseitig in Resistenz und Toleranz. „Speziell bei den Pilzen ist zu beobachten, dass deren Toleranz gegenüber antifungalen Medikamenten steigt. Und das ist fatal, wenn man bedenkt, dass zur Behandlung von Pilzinfektionen derzeit nur drei Medikamentengruppen zur Verfügung stehen.“
Passiert es dann, dass nicht nur das Antibiotikum auf resistente Bakterien trifft, sondern auch die Pilze nicht mehr auf die antifugalen Mittel ansprechen, muss der menschliche Organismus ohne wirksame antimikrobielle „Helfer“ einen Kampf gegen zwei Infektionen führen.
Auch Ralser und sein Oxforder Kollege wollen nach Abschluss der BUA-Förderung Anschlussgrants einwerben, denn das Ziel steht fest: „Wir wollen herausfinden, wie genau der Austausch von Informationen zwischen den Pilz- und den Bakterienzellen funktioniert – um mit diesen Erkenntnissen zur Entwicklung neuer Medikamente oder Weiterentwicklung vorhandener Mittel beizutragen.“
Weitere Informationen
Die beschriebenen Projekte der Oxford-Berlin-Kooperation werden von der BUA mit insgesamt 650.000 Euro gefördert.
„Context-driven Infection Control Interventions“,
PI: PD Dr. med. Friederike Maechler (Charité – Universitätsmedizin Berlin), Prof. Christiane Dolecek (University of Oxford), Dr. Tochi Okwor (CDC Nigeria), Co-Antragstellende: Prof. Joachim Trebbe (Freie Universität Berlin), Prof. Dr. Ben Cooper (University of Oxford), Dr. Tim Eckmanns (Robert Koch-Institut Berlin, RKI)
„Bacterial-Fungal Co-Infections and Their Role in the Evolution of Antimicrobial Resistance“, PI: Prof. Dr. Craig MacLean (University of Oxford), Prof. Dr. Markus Ralser (Charité – Universitätsmedizin Berlin), Co-Antragstellende: Dr. Rachel Wheatley (University of Oxford), Dr. Lisa Juliane Kahl (Charité – Universitätsmedizin Berlin), Dr. Federica Agostini (Charité – Universitätsmedizin Berlin)
Drei weitere Cooperation Groups mit der University of Oxford wurden mit BUA-Mitteln gefördert. Es sind bereits abgeschlossene sozialwissenschaftliche Projekte der „Grand Challenge Social Cohesion“:
„Fairwork“, BUA-Partner: Technische Universität Berlin und Humboldt-Universität); Transitions and Social Cohesion in the Context of Multiple Crises, BUA-Partner: Freie Universität Berlin; Oxford-Berlin Initiative on Museums as Spaces of Social Cohesion and Conflict, BUA-Partner: Technische Universität Berlin.